化療藥物5-FU再進化,老藥新用的研究趨勢
美國西北大學重新設計一種常用化療藥物的分子結構,讓它的溶解度更高、療效更好、毒性更低,在癌症治療展現令人鼓舞的前景。
癌症治療一直是門平衡的藝術,既要足夠強效來殺死癌細胞,又不能過度消耗患者的體力。近幾十年來,化療一直遊走在這條危險道路的邊緣,雖挽救了生命,卻也讓不少患者飽受噁心、嘔吐和虛弱等折磨,害怕再面對下一輪治療。
這是癌症患者難以迴避的痛,也深深困擾著醫師。西北大學研究團隊認為他們已找到一個方法,可以改變這個困境。他們針對5-氟尿嘧啶(5-FU)這種常見的化療藥物,重新設計,讓它既能精準攻擊癌細胞,又不會傷到正常細胞,而這篇論文於2025年10月29日發表在《ACS Nano》期刊。
這篇論文通訊作者,領導這個研究團隊的西北大學George B. Rathmann化學講座教授Chad A. Mirkin,日前透過該校發佈的新聞資料表示,在小鼠的動物實驗中,他們已經證明這種重新設計的藥物可以阻止腫瘤生長,如果未來能應用在人類身上,將會是一項令人振奮的進展。
他進一步解釋,這意味著更有效的化療、更高的緩解率,以及更少的副作用,而這始終是癌症治療的目標。
/
傳統5-FU治療方式痛苦,效果有限
5-FU早在1962年就被FDA核准用於治療大腸直腸癌,至今仍是醫師常用的化療藥物,它的療效顯著且可靠,但因無法有效到達癌細胞,又會不分青紅皂白地攻擊癌細胞和健康組織,常引起噁心、嘔吐、疲倦等副作用,在極少數情況下,甚至會引起心臟衰竭,對許多患者來說,治療過程的痛苦,幾乎和疾病本身一樣難以忍受。
Chad A. Mirkin認為,問題不在於5-FU等化療藥物本身,而是人體如何代謝它。大多數藥物需要先溶解在血液中,才能透過血液循環進入細胞,如果藥物溶解度低,就會結塊或維持固態,無法被人體有效吸收,治療效果有限,副作用也大。
化療藥物溶解度通常都很低,才會造成那麼大的毒性及副作用,5-FU的溶解度不到1%,當然也是如此。因此,Chad A. Mirkin和研究團隊必須找到可以讓這些化療藥物更具水溶性的方法,可以有效抵達癌細胞的病灶處,增加治療效果,同時減少副作用。
/
球形核酸SNA奈米改造5-FU,更少劑量、更好療效、更少副作用
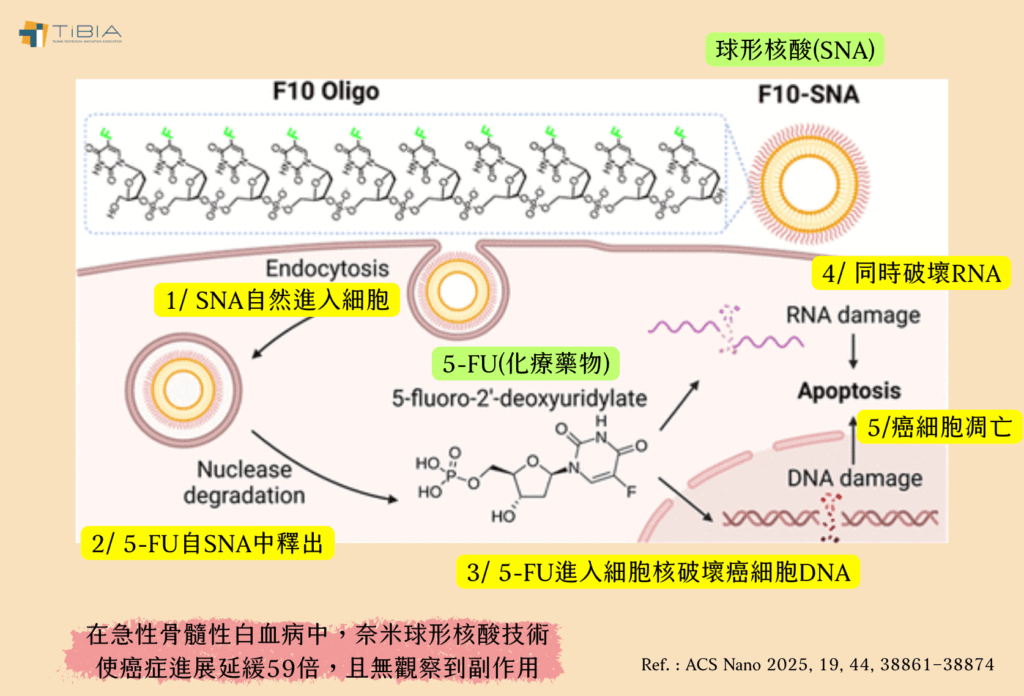
他們把目標放在Chad A. Mirkin發明的球形核酸(SNA)這種單鏈奈米結構,其核心是奈米顆粒,研究人員先在其外層包裹著緻密的DNA或RNA外殼,再將5-FU纏繞在DNA鏈中。
Chad A. Mirkin表示,大多數細胞表面都有清道夫受體(scavenger receptors),而中幼粒細胞(myeloid cells)會過度表達這些受體,讓它數量更多。一旦中幼粒細胞識別出這些奈米結構,就會將其拉到細胞裡面,因此SNA不需要強行進入細胞,就會被這些受體自然吸收。
一如他們預料,這種奈米結構會徹底改變5-FU與癌細胞的相互作用模式。當這些奈米結構進入細胞內部,接下來酵素就會分解它的外殼,釋放出裡面的5-FU藥物分子,從內部殺死癌細胞。
研究團隊透過急性骨髓性白血病(AML)的小鼠模式進行動物實驗,發現和標準化療藥物相比,這種攜帶了5-FU的SNA結構,進入AML細胞的效率提高了12.5倍,殺死AML細胞的效率提高了2萬倍,並將癌症進展減緩了59倍,而且沒有觀察到任何副作用。
如果這些結果也在人體試驗中得到驗證,化療或許會從一場戰爭轉變為一種策略,醫師或許可以用更少的劑量,獲得更好的療效,患者也能在治療過程中保持體力,而不是逐漸衰弱。
/
奈米結構應用於老藥新用,更多病患受惠
除了癌症,這種奈米結構未來也可應用在傳染病、神經退化性疾病和自體免疫疾病的有效疫苗和療法。Chad A. Mirkin認為這是個全新思維,也可能會是癌症治療的轉捩點,因為這已不再是研發新藥的問題,而是賦予老藥新生命,讓它們更具療效,也讓更多病患受惠。
/
Ref. :https://pubs.acs.org/doi/10.1021/acsnano.5c16609
/