此外,2022年通過的《The Diverse and Equitable Participation in Clinical Trials(DEPICT)Act》與《Food and Drug Omnibus Reform Act(FDORA)》法案,旨在透過要求新藥在所有三期臨床試驗中提交「多樣性行動計劃」,強化臨床試驗中的族群人口多樣性資訊,並向代表性不足的社區提供資源,改善該區居民對臨床試驗的准入和參與。同樣的要求也適用於使用510(k)程序的所有醫療設備和診斷工具。然而,隨著2025年新行政命令的發布,美國政府將在本週三之前停止所有與DEI(多元化、公平性、包容性)相關的工作。此舉將導致負責該領域的員工被強制休假或面臨解僱,並可能迫使設有DEI辦事處或計劃的機構關閉,這意味著FDA等機構的DEI工作將全面暫停,對其未來的政策和發展方向產生重大影響。
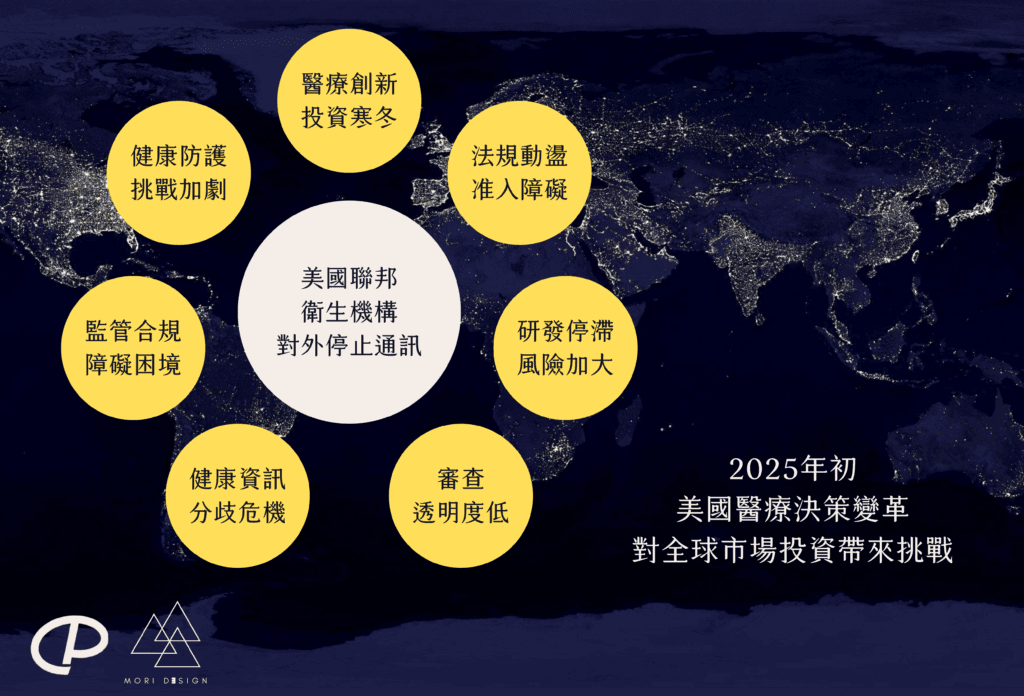
隨著美國FDA、CDC、HHS等機構的溝通中斷等事件,無論是合作項目還是各項進展,都可能面臨不可忽視的延誤。儘管尚不確定此措施的持續時間,但其對美國多元化政策、臨床試驗多樣性以及相關醫療監管法規的影響已經顯現。這些變動將進一步波及國際合作、醫療創新及生技投資,對未來的發展方向構成重要挑戰。以下將分類闡述這些影響並分析。
/
1. 醫療創新生態鏈遭遇寒冬
🔸初創企業陷入資訊孤島
健康科技與生技公司高度依賴 FDA、HHS、CDC 等機構的最新報導,以確保產品開發符合監管標準。如今資訊流被切斷,初創企業猶如踏入迷霧中前行,缺乏清晰方向,不僅增加產品研發時程與風險,也可能間接導致資金斷鏈。
🔸投資市場信心動搖
創新醫療投資高度依賴監管機構的透明度,如今市場不確定劇增,投資人也需轉舵而行,轉向中短期報酬較穩定但創新性較低的市場地區。這或許將直接影響新藥、CGT療法與突破性醫材的發展,進而拉長全球醫療科技的創新週期。
/
2. 國際法規協調與合規挑戰加劇
🔸跨國企業面臨監管碎片化
美國醫療監管政策過去與歐盟、加拿大、日本等市場接軌,如今美國突然改變立場,其他國家可能被迫各行其是,增加跨國藥企的合規成本,甚至影響美國藥械產品的全球市場佈局。
🔸全球標準化受阻,市場准入風險升高
國際監管協調(如ICH指南)高度依賴美國機構與廠商參與,如今美國退出,可能造成標準分歧,影響全球市場的准入。
/
3. 科學審查公信力與數據完整性危機
🔸醫學權威機構的影響力削弱
FDA、CDC、HHS過去是全球公認的醫療科學權威,在政經因素影響下,未來醫界與產業界對其科學審查的透明度與公正性產生疑慮。
🔸人工智慧與大數據應用受阻
現代醫療 AI 高度依賴大規模臨床數據和流行病監測,封鎖健康資訊將削弱 AI 在疾病預測、個人化醫療與藥物開發的作用。
/
4. 公共健康風險上升,國際健康防護網受挑戰
🔸關鍵健康資訊難以及時傳遞
美國政府的封鎖政策可能導致關鍵健康資訊無法即時公開,影響疫病監測與防治。例如,CDC 原計畫發布 H5N1 禽流感的最新疫情,但因政策受限,資訊發布被迫延遲。
🔸全球疾病監測與應對能力削弱
美國退出 WHO 後,全球健康數據共享恐受影響。如果發生新疫情,各國將缺乏北美重要經濟體早期監測數據,全球應對能力將大幅下降。
🔸醫療決策政治化,影響科學獨立性
美國政府對健康資訊的封鎖,可能導致醫療決策被政治考量主導,而非基於科學數據。例如,疫苗政策可能因政治因素而改變,影響公眾信任。
/
5. 藥品與醫療器材開發進度受阻
🔸新藥與醫材開發進入不確定時代
健康資訊的封鎖使研究人員難以獲取最新監管標準與疾病數據,導致新藥與醫療器材研發進程放緩。
🔸審批流程透明度下降,市場推進受阻
FDA 對外溝通的中斷,可能導致藥品與醫療器械的審批時間延長,影響企業市場計畫。
/
6. 健康經濟學視角:資訊不對稱與市場失衡
🔸市場資訊不對稱加劇
醫藥企業與投資者無法獲取最新監管動態,決策將更具不確定性,影響市場效率。
🔸企業合規成本飆升
監管資訊封鎖,將迫使企業投入更多資源進行額外合規研究與諮詢,中小企業將雪上加霜,競爭力進一步削弱。
/
總結
美國政府封鎖健康資訊與退出 WHO 的決策,將全球醫療產業推向多事之秋。資訊流的阻斷不僅影響醫療創新,也將衝擊全球健康治理與市場秩序。面對這場變局,全球醫藥界如何適應,也將決定未來醫療科技的發展方向。
/
Ref. :
https://www.nytimes.com/2025/01/22/us/politics/trump-dei-diversity-officials-orders.html




